ADC 치료제란
항체와 약물의 결합이라고 알려진 ADC(Antibody-Drug Conjugate)는 항체와 항암제를 결합시켜, 항체의 표적이 되는 종양세포에 대해 항암제를 전달하는 기술로써 종양세포 표면에 존재하는 특정 단백질에 결합하여 종양세포를 표적으로 한다. 이때 항체의 선택적인 결합력은, 선별적으로 종양세포만을 대상으로 하여 주변 정상세포를 손상시키지 않게 한다. ADC 기술은 항암제를 항체에 결합시켜, 항체가 선택적으로 결합한 종양세포 내부로 항암제를 전달하는 방식으로 항암제의 치료효과를 증대시키면서도 부작용을 감소시킬 수 있다.
ADC는 체내 순환 시 혈액에서 안정적으로 유지되고 치료 타깃에 정확하게 도달하여 페이로드를 방출하도록 고안된다. 표적 항원 및 항체 발굴, 링커의 최적화, 적절한 페이로드의 선정을 통해 ADC의 치료 효능 및 안전성을 높이기 위한 연구개발이 계속되고 있다.
ADC 구성요소(항체, 링커, 페이로드) 별 특징 및 종류
ADC는 항체, 링커, 페이로드로 구성되며 최적의 ADC 치료제는 체내 혈액에서 순환 시 혈류에서는 약물이 안정되고 표적 세포 내에서 절단되어 페이로드를 방출한다. 각 요소는 ADC 효능과 안전성에 영향을 미칠 수 있기 때문에 ADC 개발에서는 표적 항원, 항체, 링커, 페이로드 및 접합 방법을 선택하여 모든 핵심 구성 요소를 고려해야 한다.

- 항체(Antibody): ADC의 핵심 구성 요소인 항체는 특정 종양세포를 표적으로 하는 역할을 한다. 항체가 결합하는 특정 단백질이 종양세포 표면에 존재하기 때문에 항체의 선택적인 결합력은, 선별적으로 종양세포만을 대상으로 하여 주변 정상세포를 손상시키지 않게 한다.
- 링커(Linker): 항체와 항암제를 결합시키는 링커는 ADC의 항체 부분과 페이로드 부분을 연결하는 역할을 한다. 일반적으로 연결체는 두 가지 부분으로 이루어져 있으며 항체와 결합하는 부분인 항체 결합 도메인(Fab)과 링커와 결합하는 부분인 링커 도메인이 있다.
- 페이로드(Payload) : ADC의 항체와 항암제를 결합하는 또 다른 중요한 구성 요소는 페이로드이다. 페이로드는 항체에 의해 특정 종양세포로 운반되어 그곳에서 효과를 발휘하며 페이로드는 종양세포를 파괴하거나 성장을 억제하는 방식으로 작용한다. ADC에 사용되는 페이로드는 보통 세포독성이 높은 화합물로, 약물분자 자체로는 부작용이 많은 경우가 있지만, 항체와 결합하여 종양세포를 선택적으로 표적 하게 된다.

종양 표적 항원과 ADC 간의 특이적 결합에는 항체의 역할이 중요하다. 항체는 표적세포로 페이로드를 전달하는 전달자 역할을 하며, 효율적으로 endocytosis를 촉진하고 낮은 면역원성과 긴 반감기를 가져야 한다. 승인된 ADC 약물의 표적 항원은 고형암의 경우 HER2, TROP2, Nectin-4, EGFR 등이 있고 혈액암의 경우 CD19, CD22, CD33, CD30, BCMA, CD79b가 있다. 대표적으로 알려진 HER2 타깃 ADC 치료제는 아스트라제네카와 다이이찌산쿄의 엔허투가 있으며 Trop2 타깃은 길리어드의 트로델비, CD19 타깃 ADC 치료제는 ADC 테라퓨틱스의 zynlonta 있다.
ADC의 링커는 항체와 페이로드를 화학적으로 연결하며 ADC의 안정성 및 페이로드의 방출과 관련된 핵심 요소로 ADC의 궁극적인 치료 지수를 결정한다. 링커는 ADC 응집을 유도하지 않아야 하며 혈장에서 페이로드의 조기 방출을 억제하고 원하는 표적 부위에서 활성 약물 방출을 촉진해야 한다. 현재 혈액 내에서 안정적으로 순환하며, 종양 부위에서 정밀하게 제어되면서 약물을 방출할 수 있는 링커 기술에 대한 연구개발이 활발하다.
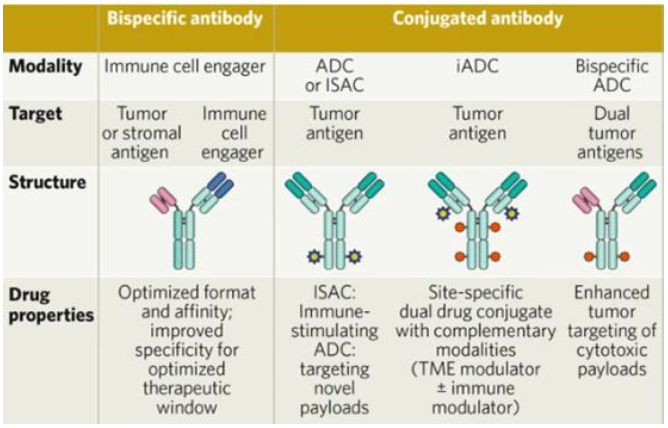
페이로드는 표적세포에 작용하여 endocytosis를 통해 세포 내로 들어오면 세포독성을 발휘한다. ADC의 약 2%만이 정맥 내 투여 후 표적에 도달할 수 있어 페이로드로 사용되는 약물은 높은 효능을 가지고 생리학적 조건에서 안정적으로 유지 및 항체와 결합할 수 있는 기능 그룹이 있어야 한다. 현재 ADC에 사용되는 페이로드는 주로 튜불린 억제제, DNA 손상제, Topoisomerase I inhibitor 등이며, 최근에는 이 외에도 새로운 메커니즘을 가진 다양한 페이로드를 적용하려는 시도가 이루어지고 있다. 암세포를 타깃으로 항체에 결합시켜 면역 체계를 자극하는 면역자극 항체 접합체(iSACs: Immune-stimulating antibody conjugates)가 그중 하나이다. 기존의 ADC가 암세포를 직접적으로 사멸시키는 개념이라면 iSAC는 면역자극 약물을 붙인 항체를 통해 면역 체계를 활성화하여 항암 효과를 얻는다. iSAC의 경우 페이로드로 TLR agonist와 STING agonist가 연구개발 되고 있고, 2022년 STING 관련 2개의 글로벌 딜이 주목을 받았다.
ADC 글로벌 기술이전
2022년 8월, GSK는 Mersana therapeutics는 HER2-STING 활성화 ADC인 전 임상 후보물질 'XMT-2056'에 대해 선금 1억 달러(한화 약 1313억 원), 옵션 행사 시 최대 13억 6000만 달러(한화 약 1조 7846억 원)를 지급하는 빅딜을 체결하였고, 더불어 12월에는 독일 머크도 Mersana therapeutics와 XMT-2056을 대상으로 8.3억 달러(한화 약 1조 원) 규모의 기술이전 계약을 체결했다. XMT-2056의 항체는 기존의 항 HER2 항체들(Pertuzumab 또는 Trastuzumab)과는 다른 신규 항원을 인식하며, XMT-2056는 FDA로부터 위암 치료를 위한 희귀 의약품으로 지정되었다.
그 밖에도 2022년 2월 Mersana therapeutics는 얀센과 10억 달러(약 1조 2474억 원) 규모의 ADC 공동개발 및 라이선스 계약을 체결하였고, 3월에는 사노피가 miRecule과 ARC(Antibody-RNA Conjugation) 기술에 대한 공동개발 계약을 4.3억 달러(약 5366억 원) 규모로 체결하였다. 10월에는 이중항체와 함께 ADC 플랫폼을 보유한 자임웍스가 재즈파마슈티컬에 HER2 이중항체 자니다타맙(Zanidatamab)을 17 얼 6250만 달러(약 2조 2000억 원)에 기술이전하는 빅딜로 주목을 받았다. 또한 Synaffix는 12월 암젠과 20억 달러(약 2조 5000억 원) 규모의 옵션 계약을 통해 글리이코 커넥트(GlycoConnect) 기술, 하이드로스페이스(Hydrospace) 플랫폼, 링커-페이로드 결합체(toxSYN) 기술을 포함한 ADC 플랫폼 기술을 라이선스 아웃하였다.
[참고 문헌]
1. KDDF 신약개발 Global Trend 분석 - ADC
2. 리포트 40호 바이오베터 기술개발동향 ADC 개발 동향
'제약·바이오 정보' 카테고리의 다른 글
| [제약/바이오] 바이오베터 (Biobetter) 개발 동향 - 1 (0) | 2023.03.03 |
|---|---|
| [제약/바이오] ADC 치료제 (Antibody Drug Conjugates) - 2 (0) | 2023.03.03 |
| [제약/바이오] 면역항암제 (Cancer Immunotherapy) - 2 (0) | 2023.02.28 |
| [제약/바이오] 면역항암제 (Cancer Immunotherapy) - 1 (0) | 2023.02.28 |
| [제약/바이오] 이중특이항체(Bispecific-Antibody) - 2 (0) | 2023.02.23 |